| 
L’eau pourtant
si répandue à la surface de la Terre, reste une
énigme. Dans la nature, c’est le seul liquide qu’on
connaisse dans les
conditions habituelles de pression et de température
qui règnent au sol. Les autres liquides ne sont que des
mélanges d’eau et d’autres composés.
Devant une telle originalité, les physiciens n’hésitent
pas à parler de liquide anormal. Pour être plus
précis, ils ont identifié un
certain nombre d’anomalies de l’eau dont trois principales
des comportements qui la rendent unique.
Nous
disons cela, précise José Teixeira, chercheur
au Laboratoire Léon Brilouin parce que sa structure est
très différente des fluides idéaux comme
l’argon qui nous servent de modèles d’étude.
De plus, lorsqu’on la compare à d’autres
molécules présentes dans la nature, son comportement
continue à nous échapper. Bernard Cabane, du Laboratoire
de physique et mécanique des milieux hétérogènes,
ajoute ainsi : « Si on regarde les cléments qui
suivent directement l’oxygène l’eau est de
formule chimique H2O, un atome d’oxygène lié
à deux atomes d’hydrogène dans la classification
périodique pour essayer de savoir sous quelle forme est
l’eau à température ambiante, alors tout
laisse à penserd’une molécule (H20) peut
se lier à un autre atome d’oxygène d’une
molécule voisine. En moyenne, une molécule d’eau
est ainsi liée à quatre autres. « Et c’est
cet arrangement des molécules qui explique en partie
les propriétés dccc précieux liquide, ajoute
José Teixeira. Mais il faut aussi tenir compte de la
manière dont les liaisons hydrogène se font et
se défont. »
 |
Pour le moment, les physiciens ont réussi
à observer qu’elles se créent et se
détruisent sans arrêt - chacune vit en moyenne
un millième de milliardième de seconde,
qu’un grand nombre d’entre elles se forment
et qu’il faut que les trois atomes concernés
soient parfaitement alignés pour qu’une liaison
apparaisse. Or, de tous les liquides, l’eau est
le seul à réunir ces trois caractéristiques.
Et c’est sans doute ce qui explique en partie les
fameuses anomalies décrites par les chercheurs
: d’un côté, l’eau n’est
pas un gaz à température ambiante, parce
que les liaisons hydrogène sont suffisamment fortes.L'eau
est donc douéed’une grande force de cohésion.
Résultat : il faut apporter beaucoup d’énergie
pour rompre ces liaisons, ce qui explique qu’elle
ne bout qu’à 100 °C. De l’autre,
ce n’est pas non plus un solideà température
ambiante, parce que les liaisons sont tout de même
fragiles. |
| Pour
José Teixeira, une connaissance plus profonde de
la dynamique de la liaison hydrogène est indispensable
si on veut vraiment comprendre l’eau un jour. Bernard
Cabane va lui aussi dans ce sens : « Il nous manque
encore beaucoup d’informations sur l’eau pour
avoir un modèle réaliste et prédictif
de son comportement. On a beau connaître la nature
des liaisons entre molécules, tant qu’on ne
saura pas comment une molécule isolée interagit
non seulement avec ses premières voisines mais aussi
avec les autres, alors le modèle ne sera pas bon.
. Et les simulations numériques actuelles lui donnent
raison. En effet, si on essaie de rendre compte des trois
principales anomalies particulières de l’eau,
les modèles n’en reproduisent qu’une
ou deux. Jamais les trois en même temps. Liaison hydrogène:
elle s’établit entre deux molécules
identiques ou non. C’est le déficit de charge
portée par l’atome d’hydrogène
qui permet l’apparition de la liaison. Mais les physiciens
ne sont pas à court d’idées pour tenter
de lever le mystère. Pour cela, ils étudient
sa structure à froid. « Les liaisons hydrogène
sont plus stables en dessous de 0 °C, explique José
Teixeira. On peut alors tenter de mieux comprendre l’eau
liquide si on suit son évolution jusqu’à
- 40°C. » Liquide jusqu’à -40 °C
? Oui, si elle est débarrassée de toutes ses
impuretés, sans quoi elle cristallise immédiatement.
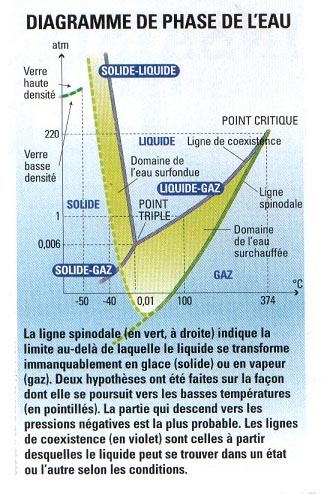
Les scientifiques appellent cela la surfusion (voir
diagramme de phase), qui existe d’ailleurs pour d’autres
liquides, comme le toluène, le gallium ou la silice
fondue. « Pour le moment, le record pour l’eau
est à - 42 °C - à peine mieux que pour
l’eau sur-fondue présente dans certains nuages
atmosphériques, précise Frédéric
Caupin, chercheur au Laboratoire de physique statistique
de l’ENS. En dessous de - 40 °C, rien que l’agitation
thermique des molécules d’eau semble suffisante
pour que le liquide se transforme en glace. Passée
cette barrière de température, la durée
de vie de l’eau liquide devient extrêmement
brève. Les physiciens n’ont alors plus le moyen
de l’observer. |
 |
C’est aux alentours
de -130 °C qu’apparaît un autre phénomène
intéressant : si l’eau est refroidie suffisamment
vite jusqu’à cette température, elle se
transforme en glace amorphe, c’est-à-dire
qu’elle a la structure du verre (voir p. 16). Une constatation
s’impose « On ne sait rien sur la structure de l’eau
entre - 40 °C et -130 °C ", avoue José Teixeira.
Non sans humour, les chercheurs appellent cette zone le «
no man’s land ». Rebondissement en 1984 : les physiciens
Mishima, Calvert et Whalley découvrent une deuxième
forme de glace, amorphe, plus dense que la première,
en comprimant la glace ordinaire à très basse
température. Un résultat qui a fait resurgir des
idées anciennes. En effet, en 1892, Röntgen avait
émis l’hypothèse que l’eau était
un mélange de liquide et de glace. Aujourd’hui,
certains voient dans la découverte des deux formes de
glace amorphe une piste prometteuse : l’eau serait, au
moins à basse température, un mélange de
deux liquides, l’un de faible densité et l’autre
de haute densité. Une idée qui laisse un peu sceptique
José Teixeira. Et il suggère que le responsable
est encore et toujours la liaison hydrogène. Mais comment
trancher, alors que le no man’s land reste inaccessible
aux mesures ? Une solution : améliorer les expériences
dites de cavitation, qui se déroulent à température
ambiante et à des pressions qualifiées de «
négatives » .
|






